2023年12月26日
HPV検査単独法で細胞診はどう変わるかーバイオロジーと形態から考える
さる11月5日に福岡市国際会議場で開催された第62回日本臨床細胞学会秋期大会の最後のプログラムである細胞診専門医セミナーで講演をする機会をいただきました。
子宮頸がん検診における細胞診の位置づけが、Human papillomavirus(HPV)検査単独法の導入により変わろうとしています。その背景にはHPVの生物学的特性と扁平上皮内病変squamous intraepithelial lesion(SIL)の自然歴に関する知見の集積があることはいうまでもありません。従来のパパニコロウ Papanicolaou 分類からベセスダシステムBethesda system への移行により、細胞診の役割は形態に基づく厳密な病変推定からリスク評価へと変わりました。ベセスダシステムの本質は【感染性の異型】、すなわちコイロサイトーシスkoilocytosisという形態的バイオマーカーと【腫瘍性の異型】を認識することによる高度病変の検出です。しかし、形態認識、つまり細胞変化から HPV 感染状態にあるか否かを判定することの限界が以前から指摘されていた。その一方で、HPV の型判定 genotyping による進展リスク評価の有効性が示されたことから、近年は欧米諸国を中心に HPV 検査単独法が検診に導入されるようになりました。HPV DNA の組み込みにより E6、E7 が p53、RB 蛋白を不活化して細胞の不死化と自律的無制限の増殖を惹起し、ゲノム不安定性および変異・異常の蓄積が生じ、やがて浸潤能および転移能を獲得して扁平上皮癌に至るわけですが、これら一連のプロセスを細胞形態は必ずしも正確に反映しません。特に初期段階である LSIL/CIN1 の進展リスク評価は細胞診では困難で、偽陰性も少なくありません。こうした事実を踏まえ、最近の SGO/ASCCP のガイドラインでは、HPV 検査により 16 型、18 型が検出された場合は精査、16、18 型以外の12のハイリスク HPV が検出された場合は細胞診を実施するアルゴリズムが示されています。将来的にはp16/Ki-67 二重免疫細胞化学やより洗練されたバイオマーカーが細胞診に代わる可能性もあり、実際にそれを実証する研究の結果も示されています。しかしながら、ここで強調したいのは、細胞診および細胞診を担う細胞検査士の役割がなくなるわけではないということです。
将来的には子宮頸癌検診はバイオマーカーに基づいたアルゴリズムが主流となるでしょう。しかしながら、精度管理を含めてこれまで以上に子宮頸がん検診における細胞検査士および細胞診専門医が果たす役割は高度化していくであろう、という言葉で講演を締めくくりました。
2023年12月25日
病理医の視点から婦人腫瘍学の未来を考える-『多次元的病理学 multidimensional pathology』を見据えて
臨床医学の父と呼ばれているウイリアム・オスラー(1849-1919)の「As is pathology, so is our practice」という言葉が見事に表しているように、最適な治療は正しい病態理解、すなわち病理診断を前提とする。従って、婦人科腫瘍学は婦人科病理学とともに発展してきたといっても過言ではありません。婦人科病理学はきら星のように輝く先人たちの精緻な形態観察と洞察、治療に対する患者の反応と転帰の解析などにより形づくられ、分類体系が構築されてきました。これには病理医のみならず婦人科医の貢献が大きく、特にその黎明期においては病理学者としての資質を兼ね備えた婦人科医達が婦人科病理学の進歩の原動力となりました。
婦人科病理学は高度に臨床病理学的であり、境界悪性腫瘍やインプラント、子宮内膜増殖症に代表されるような独特の、あるいは病理総論から逸脱した概念や用語、診断基準が用いられる疾患が少なくありません。そのため、一般の病理医にとってはこの専門領域が敷居の高いものとなっている一方で、魅力ある分野ともなっています。日常の診療および医学研究において病理医と婦人科医の連携は必要不可欠で、両者の関係はゲノム医療が本格的となった今日、ますます強化されていかなければなりません。
2020年に上梓された世界保健機関(WHO)による女性生殖器腫瘍の分類第5版は、近年の研究により集積された分子遺伝学的知見と臨床病理学的知見が反映された事実上の世界標準で、日常診療および医学研究のほか、対がん戦略立案のための基礎資料である疫学データに反映されるがん登録においても不可欠で、病理医・婦人科医にとどまらず、基礎医学研究者を含む医学・医療関係者の共通言語あるいは共有財産であるといえます。従って、婦人科腫瘍の分類体系は客観的なエビデンスに基づいて構築される必要があるのと同時に、平易でユーザー・フレンドリーであることも求められます。特に病理医にとっては高い診断者間再現性が担保されることが重要で、診断基準(クライテリア)は明確である必要があります。網羅的な遺伝子発現プロファイリングはこれまで単一の組織型であると考えられていた癌腫が多彩な腫瘍群であることを明らかにし、個別化医療という観点からも腫瘍の細分化されて分類の高度化が進んでいます。既に子宮体部では類内膜癌の分子亜型がWHO分類第5版に採用され、これに基づいたリスク評価がESGOによりガイドラインとして提案されており、FIGO進行期分類にも導入されようとしています。かつてWHOによる腫瘍分類は【組織分類 histological typing】でした。しかし、今日的には、臨床病理学的特徴、画像、疫学、組織発生、分子遺伝学的背景、予後、など多くの要素によって構成される【多次元的分類 multidimensional classification】となっています。この方向性は WHO の明確な意思の現れといえますが、問題が全くないわけではありません。それは【分類】と【診断】の乖離です。
腫瘍分類の最適化あるいは再構成は患者の利益を最大化するためにも必要不可欠であることはいうまでもありませんが、病理診断を含む実地診療および医療資源とのバランスも考慮されなければなければなりません。その意味において、今まさに分類体系と診断基準のあり方が問われていると私は考えています。
2023年07月30日
Evidence-based pathology
『Evidence-based pathology』という言葉があります。世界保健機関による腫瘍組織分類も現在はこの考え方に基づいて作成されています。科学的視点から病態を理解して疾患の枠組みをつくるという意味においてはこれは正に正義といってもよい思想であるといえます。では実際の病理診断はどうか。
ここで私たちが忘れてはならないことは、医療の現場における病理学、すなわち病理診断学はアート(作法)に基づくということです。様々な局面で、情報が限られている、あるいは錯綜する中で、最適な治療を模索するためのチャートが病理診断であるとすれば、当然のことながら『科学』が実践できない局面が多々あるということは認めなければなりません。つまり、病理診断において科学的基盤は重要ではあるものの、科学そのものではないといわざるを得ません。これはとくに生検診断の場合にいえます。
最適な病理診断のためには病理医としての経験(実務)と知識に加えて、論理的思考が不可欠で、そのアプローチはまさに臨床推論そのものです。ですから、前提すなわち病理診断を依頼した医師が提供した情報や患者の容態が変われば、あるいは新たな臨床情報が加われば、病理診断は修正される可能性があります。そして、病理医はその修正を恐れてはいけません。
よく病理診断は『最後の診断 Final Diagnosis』とよばれることがありますし、病理医は『医師の医師 Doctor's doctor』であるといわれることがありますが、これらは必ずしも病理診断学の事実を表していません。病理診断は病理医と担当医、関連部門に所属するスタッフの共同作業であることは理解しておく必要があるでしょう。
2019年05月22日
WHO女性生殖器腫瘍組織分類第5版編集会議@IARC
さる令和元年5月9日にフランスのリヨンで開催されたWHOが作成する腫瘍組織分類の編集会議に専門委員として出席しました。私の担当は婦人科腫瘍で、今回の改定により2020年の5月を目指して第5版の出版を目指します。会議が開催されたのは国際がん研究機関 International Agency for Research on Cancer(IARC)。この IARC は厳密にはWHOの外部組織で、1965年に設立されました。フランスが主導していますが、日本を含めて先進諸国が拠出金を提供しています。化学物質や放射線などの発がんリスク分類を作成していることで知られていますが、腫瘍の病理組織分類の世界標準である WHO 分類(いわゆる Blue Boook)も出版しています。今回の会議では世界各国からの婦人科腫瘍の専門家とディスカッションし、全体の構成と執筆者案を作成しました。タイトな一日でしたが、終了後はベルクール広場に面したレストランで夕食。美味しいワインが花を添えてくれました。
2018年10月06日
AGC 異型腺細胞 -続き
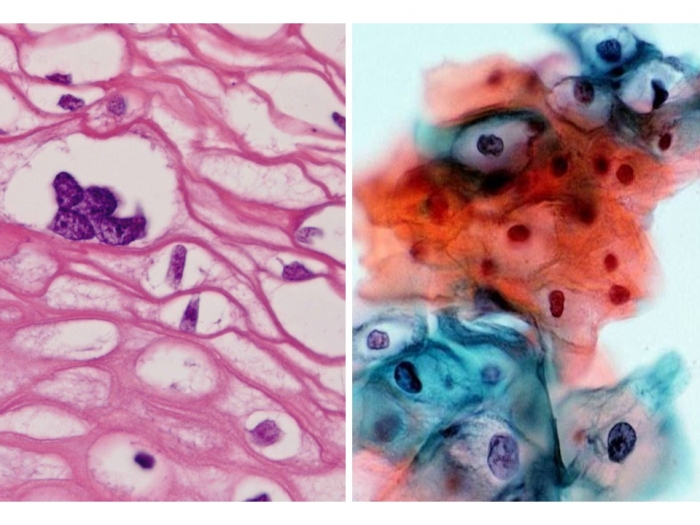
異型腺細胞。このこの用語自体は以前から使用されてきましたが、子宮頸部細胞診においては1988年の提案されたベセスダシステム(TBS)で正式に細胞診判定用語として採用され、その基準が設定されました。その後2001年、2014年の改定を経て現在に至っています。
この用語を巡る問題は多岐にわたるのですが、ここでは子宮頸部上皮内腺癌に限定して述べます。ベセスダシステムでは、その意義が不明なものを「特定不能な異型腺細胞 Atypical glandular cells, NOS(not otherwise specified)」、「腫瘍性を疑う異型腺細胞 Atypical glandular cells, favor neoplastic」とよんでいます。前者はさらに、① 内頸部細胞、② 内膜細胞、③ (単なる)腺細胞、の3つ、後者は、① 内頸部細胞、② (単なる)腺細胞、の2つのカテゴリーに分けられます。この中で「腫瘍性を疑う異型内頸部細胞」は浸潤腺癌ではなく、上皮内腺癌を想定して判定基準が設定されています。
これまでの研究の結果から、異型内頸部細胞が検出された場合には、約50%の頻度で上皮内腺癌や浸潤腺癌、CIN3、扁平上皮癌などの高度病変であることが後に判明することがわかっています。そのため、この判定がついた場合にはコルポスコピーと生検による組織診を用いた精査が行われます。このことは半数の例では結果的に不要な検査が行われることを意味しています。こうした理由から、異型内頸部細胞は「特定不能」,「腫瘍性を疑う」の2つに分けられ、精査の結果が陰性であれば前者の場合は経過観察、後者の場合は円錐切除が考慮されます。実際、高度病変が後にみつかる頻度はそれぞれ10~20%、80~90%となっています。ところが、日本ではこの2つが分けられておらず、管理指針も定められていません。次回はその原因と派生する問題について考えてみたいと思います。
2018年06月15日
AGC 異型腺細胞
検診の普及によって子宮頸癌は半世紀の間に罹患率が劇的に低下しましたが、これはその主な組織型である扁平上皮癌の減少によるもので、実は腺癌は相対頻度、絶対数とも増加傾向にあります。かつては子宮癌全体の5%~10%程度を占めるに過ぎませんでしたが、現在は腺癌の占める割合は 20~25% に達しています。絶対数が増加している理由が全くわかっていませんが、相対的に増加している原因として、細胞診による検出が難しいという問題があります。そのため、細胞診によっていかにして早期の腺癌を見つけ出していくべきであるのか、ということが真剣に議論されています。
さる6月2日(土)、3日(日)の2日間にわたって札幌市において第59回日本臨床細胞学会総会春期大会(会長:札幌医科大学産婦人科 斉藤 豪 教授)において、このAGCの取扱いについて議論するために「子宮頸癌検診における腺癌の早期発見」と題するワークショップが開催されましたが、ここでAGCをめぐる問題点が浮き彫りとなりました(続く)。
2018年04月14日
2つの病理診断 Two Diagnoses for One Case ?
病理診断は近年、臓器あるいは疾患ごとに高度な専門化を遂げています。そのため、一般の病理医と個々の領域における専門家、いわゆるエキスパートとよばれる病理医の診断が異なることがあります。また、病理専門医の資格を持たない外科や内科などの診療科の医師の中にも、自分たちが扱う臓器や疾患の病理診断学に精通している方々がおられ、病理医の診断を修正して治療を進める、ということが実際にあります。臨床検査データや経過が合致しないという理由から診断に関する疑義が生じ、診療科医師が標本を他の施設のエキスパートである病理医にコンサルテーションを依頼し、その結果診断が修正されることもあります。従って、症例によっては一人の患者の同じ標本をみているにもかかわらず、2つ(あるいはそれ以上)の診断が存在することになります。
法律上は医師の資格を有していれば、病理専門医でなくても病理診断を行うことができます。しかし、社会通念上、あるいは医療に対する患者の不審を招く可能性があるため、2つの診断が存在しつづけるという事態は避ける必要があります。このような問題への対応はそれぞれの医療施設に委ねられていますが、全く対策がなされていない施設も少なくないのが現状です。その理由は、この問題があまり広く認知されておらず、コンセサスやガイドラインのようなものがないためです。
この問題を解決するためには、私は病理医と当該症例を担当する診療科の医師が診断に関して協議を行い、診断の修正や変更が必要であると判断された場合はそれを電子カルテ上に記録として残すのがよいと考えています。実際に私が以前勤務していた京都大学のある診療科では、定期的にカンファランスを行い、出席した病理医と診療科長が診断に関して協議した内容が電子カルテに記載されていましたが、診断が変更される場合にはその根拠が明示されました。このようにすることで、病理医の診断と異なる第2の診断が一人歩きすることを避けることができます。
これに関連することとして、臓器別、疾患別に様々な学会や研究会で開催される『症例検討会』の問題があります。これは病理組織標本を持ち寄って診断に関する議論を行うというもので、病理医だけではなく、関連診療科の医師が主導して開催することがあります。多くの場合、当該領域の病理診断に精通したエキスパートである病理医がコメンテーターとして診断意見をのべたり、治療に関する助言を与えます。この『症例検討会』自体は大きな学びの機会であり、私自身もコメンテーターとして貴重な症例の標本を拝見させていただき、勉強をさせていただくことがしばしばあります。従って、病理診断の質を向上されるための1つのツールであると考えることもできます。しかし、ある施設で確定された病理診断がこの『症例検討会』で覆り、誤りであったことが判明することがあります。中には治療方針を変更する必要が生じる例もあります。このようなことが治療が開始されてから数ヶ月経過してから起こるとすれば、大きな問題となります。『症例検討会』における診断意見の取扱い、医療施設の対応の仕方も考えていく必要があります。
2016年11月20日
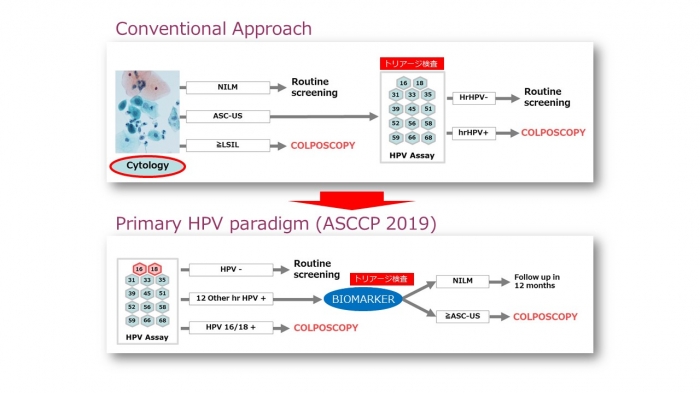
コイロサイトーシス Koilocytosis を再考する - なぜ primary HPV testing なのか
さる11月18日(金)、19日(土)の2日間にわたって大分県別府市で開催された第55回日本臨床細胞学会秋期大会(別府国際コンベンションセンター)において、「Koilocytosis を再考する」というタイトルのシンポジウムのモデレーター、座長を佐賀大学産婦人科の横山正俊教授と共につとめさせていただきました。
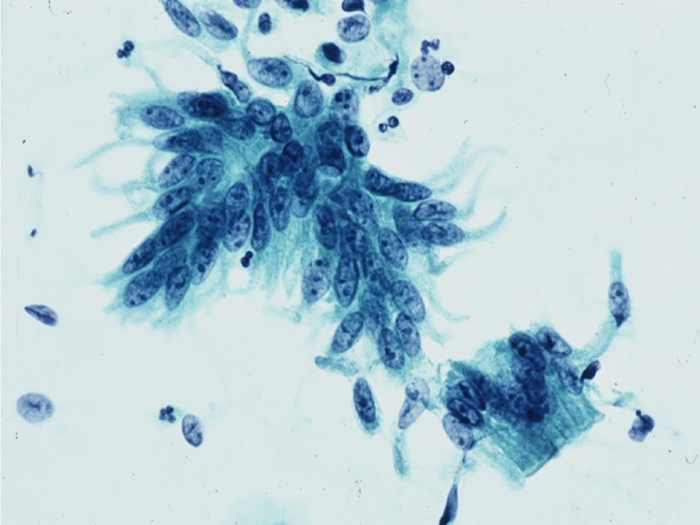
koilocytosis という現象は重層扁平上皮を構成する中層および表層細胞の核周囲の空胞、核腫大、核形不整などによって特徴づけられれる細胞変化で、ヒトパピローマウイルス(HPV)が感染し、核の中でウイルス粒子の複製が生じるために引き起こされる細胞傷害効果を反映する現象です。すなわち、koilocytosis は HPV の一過性感染を示唆するバイオマーカーであるととらえることができます。興味深いことに、HPV DNA を構成する E4 という領域がコードする蛋白がウイルス粒子を放出するために 細胞質のケラチンネットワークを破壊した結果、空胞が形成されることが明らかとなっています。
このシンポジウムではウイルス学の視点から、この領域に造詣の深い金沢医科大学産婦人科の笹川寿之教授、米国の病理専門医・細胞診専門医資格を有する熊本赤十字病院病理診断科の長峯理子先生に koilocytosis の歴史と定義、臨床的意義についてお話しいただいた後、病理組織像と鑑別診断について滋賀医科大学医学部附属病院病理部の森谷鈴子准教授に解説をいただき、最後に子宮頸がん検診の将来展望について自治医科大学附属さいたま医療センター産婦人科の今野良教授にお話をいただきました。
子宮頸がん検診は細胞診を用いて行われており、LSIL(軽度上皮内病変)、HSIL(高度上皮内病変)、AIS(上皮内腺癌)、浸潤癌と判定された場合にはコルポスコピーと生検、すなわち精密検査が行われます。LSIL は一過性の HPV 感染であり、その判定基準(クライテリア)において koilocytosis の存在が重視な位置を占めています。LSIL 自体は殆どが自然に消退してしまうため、治療の対象ではありませんが、HPV 感染が持続している場合には潜在的に HSIL あるいは浸潤癌などの治療を必要とする高度病変が 20~30% の頻度で併存していることがあるため、精密検査の対象となります。HSIL が疑われるものの断定が困難である場合には ASC-H(HSIL が否定できない異型細胞)と判定されますが、約 60~70% の例で高度病変がみつかるため、LSIL と同様に精密検査が行われます。
ここで問題となるのが、LSIL が疑われるけれども断定が難しい場合、すなわち ASC-US(意義不明な異型扁平細胞)と判定された場合の取り扱いです。現在のガイドラインでは、HPV DNA テストによるトリアージ(ふるい分け)が行われ、陽性の場合にのみ精密検査が行われます。その理由として、ASC-US 判定例における高度病変の検出率は 10~15% に過ぎないため、ASC-US と判定された女性全てを対象にコルポスコピー、生検を行いますと、結果的に多くの女性、すなわち 85~90% の女性が不必要な精密検査を受けることになることが挙げられます。また、産婦人科の先生がパンクしてしまうことも無視できません。ちなみに、ASC-US と判定された女性の約 50% が HPV 陽性、約 50% が HPV 陰性となることが米国の大規模な調査(ASC-US トリアージ・スタディー、ALTS)の結果明らかとなっています。子宮頸癌は殆どが HPV によって発生しますので、理論上は HPV 陰性の女性はそのリスクを無視してよいと考えることができます。従って、HPV DNA テストによって精密検査が必要な女性の数を半分に減らすことができます。
ここで、もう一つの問題があります。細胞診の普及により、子宮頸癌は約半世紀の間に劇的に減少しましたが、依然として細胞診には限界があり、一定の割合で過小評価、すなわち病変が存在するにもかかわらず細胞診判定が「陰性」となることがあります。そのため、細胞診で一次スクリーニングを行い、HPV DNA テストで ASC-US 判定例のトリアージを行うという検診の方法を改め、HPV DNA テストにより一次スクリーニングを行うという戦略が欧米を中心に提案されるようになりました。シンポジウムでは HPV の感染によって生じる細胞傷害効果、癌化のメカニズムを非常にかりやすく解説をいただき、さら HPV 感染を示唆する所見である koilocytosis の判定基準について詳細にお話いただくとともに、 HPV 感染をとらえるという意味において細胞診には限界がある、ということを数々の文献、データを元にお示しいただきました。HPV が感染している女性であっても koilocytosis が認められる頻度は 30~50% に過ぎず、中にはまったく異常が認められない女性も存在します。細胞診の本質は高い特異度、陽性予測値であり、高度病変の検出には威力を発揮しますが、LSIL を検出するためには感度という点で必ずしも理想的な検査法ではありません。こうしたことから、感度に優れた検査法である HPV DNA テストを一次スクリーニングに用いるという考え方(primary HPV tegsting)が生まれたわけです。
では、細胞診は役割を終えたのでしょうか。そうではありません。HPV DNA テストが陽性(対象者の7%程度と見積もられています)の女性に対して細胞診を行い、高度病変の有無を判定することになるのです。つまり、細胞診がより高次のツールに「格上げ」され、トリアージに活用されるということです。これにより、細胞検査士の労力と時間を有効に活用し、標本作製などにかかるコストを含む検診費用を抑制できることが期待できます。今野教授には HPV DNA テストのコストと細胞診による検診のコストを比較いただき、primary HPV testing がより費用対効果の高い方法であることをお話いただきました。HPV DNA テストは自己採取による検体で行うことも可能であるため、諸外国と比較して低い本邦の検診受診率を上昇させる契機となることも期待されます。細胞診は子宮頸がん検診において新しい役割を付与されることになるといえるでしょう。
2016年04月24日
乳がんの病理組織分類に関する議論
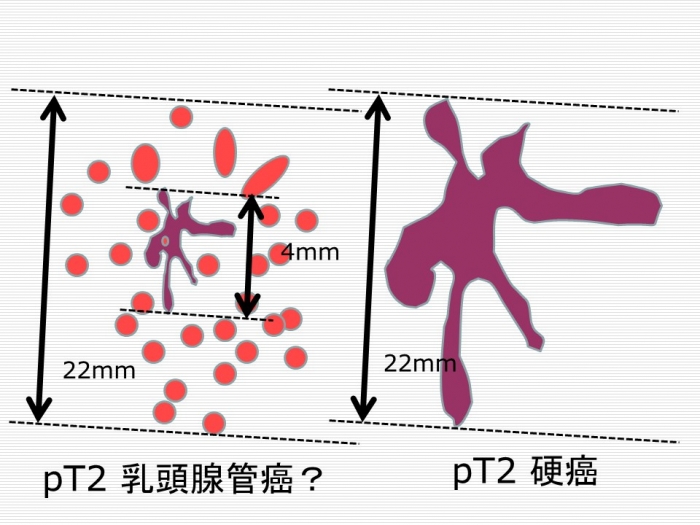
浸潤性乳癌の約 80% 程度を占める非特殊型(invasive carcinoma of no special type, WHO2012)は、本邦では(1)乳頭腺管癌、(2)充実腺管癌、(3)硬癌、の3型に細分類されています。それぞれ、乳管内圧排性進展、乳管外圧排性進展、乳管外浸潤性進展、を特徴としており、高分化型、中分化型、低分化型、として位置づけられ、予後と相関することが知られています。この分類は 1971 年に乳癌研究会が発表した「乳癌の組織学的分類」として提唱され、現在に至るまで乳癌取扱い規約分類として広く使用されていますが、この分類の有効性を系統的に検証した英語論文は存在せず、国際的に全く認知されていないという問題があります。そのため、2015 年に名古屋で開催された第104回日本病理学会総会(4月30日-5月2日)において、「わが国の乳癌組織分類はどうあるべきか」と題して乳癌取扱い規約の浸潤性乳管癌3型を議論するためのシンポジウムが開催されました。
このシンポジウムでは癌研究会有明病院の堀井理絵先生が前述した乳癌取扱い規約分類と予後や画像との相関について解説をされました。その後、シンポジウムの出席者から様々な質問、コメントがなされ、活発な議論が交わされました。私もこのシンポジウムでコメントをさせていただきましたので、その概要を以下に記します。
『(がん研究会有明病院の堀井先生は)乳管腺管癌、充実腺管癌、硬癌の組織亜型分類が予後と相関するというデータを出されていますが、この分類自体が浸潤様式、分化度(管腔形成の程度)を内包していますので、ある程度予後と相関することは当然です。しかし、この分類の意義を明らかにするためには(管腔形成の程度、核異型度、核分裂活性をスコア化して総合的に腫瘍の悪性度を評価する)ノッチンガム・グレード(modified Scarff-Bloom-Richardson 分類)を加えて多変量解析を行うなどして、これを上回る予後に対するインパクトがあることを示す必要があるのではないでしょうか。画像所見との相関を強調されていますが、広範な乳管内進展を伴い、浸潤部が管腔形成を伴わない乳管癌と、浸潤癌がすべての領域で管腔形成、乳頭状発育を示す入管癌がともに乳頭腺管癌に分類されるのは合理的ではないと思います。』
現在日本で使用されている乳癌取扱い規約分類の問題点を以下に記します。これらの理由により、私は本分類を廃止し、事実上の国際標準である世界保健機関(WHO)分類(2012年)に準拠した分類に改めるべきであるとの立場をとっています。
(1) 乳癌取扱い規約による非特殊型浸潤性乳管癌に含まれる3つタイプ(乳頭腺管癌、充実腺管癌、硬癌)は純粋な意味での組織亜型ではなく、分化度(管腔形成)、浸潤・進展様式によって規定されているに過ぎない。
(2) 一つ亜型の中に浸潤・進展様式が全く異なる腫瘍が含まれている(特に乳管腺管型)
(3) 一つの組織型の中に表現型、生物学的特性(ER、PgR、HER2 の発現状態、Ki-67 標識率)の異なる腫瘍が含まれている。実際の治療は表現型、生物学的特性の方が重要である(単一の組織型は臨床病理学的、生物学的に単一の腫瘍で構成されていることが望ましい)。
(4) 国際的に認知されておらず、通用しない。
(5) ノッチンガム・グレード(mSBR グレード)で代用可能であると考えられる。
なお、実際の病理診断報告においては、主診断である「浸潤性乳管癌 Invasive ductal carcinoma」に加えて、① mSBR Grade、②進行期(pTNM)、③ 非浸潤性乳管癌(DCIS)の有無および範囲、などを記載しますので、非特殊型浸潤性乳癌の亜分類を行わないことのデメリットはないと考えられます。治療選択についても亜分類ではなく、ER、PgR、HER2 の発現状態、Ki-67 標識率が重視されているのが現状です。
参考文献
1. 小山徹也.特集「乳腺腫瘍の組織分類はどうあるべきか?」の総括.診断病理、pp128-130、33巻2号、2016
2. The Japanese Breast Cancer Society. General rules for clinical and pathological recording of breast cancer. 2nd ed. Kanehara: Tokyo: The Japanese Breast Cancer Society; 1971 (邦文).
3. Sakamoto G. Gan no Rinsho. Suppl: 105-113, 1985 (邦文)
2016年04月13日
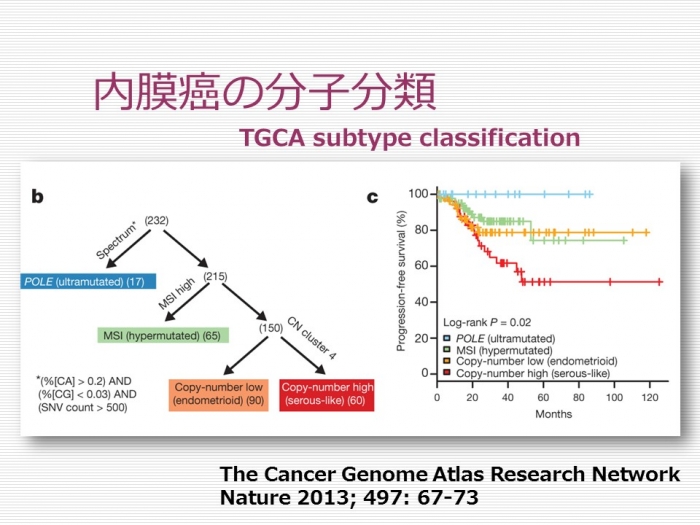
子宮内膜癌の分子遺伝学的分類 Molecular subtype ー TCGA Study
がん遺伝子のデータベースであるThe Human Cancer Genome Atlas(TCGA)を用いた内膜癌の新しい分子遺伝学的分類が提唱されています。2013年にはTCGAネットワークが、内膜癌をPOLE(polymerase ε)型(ultramutated)、microsattelite instability(MSI型)(Hypermutated)、copy number low(CN-L)型(endometrioid-like)、copy number high(CN-H)型(serous-like)に分類しました。POLE型は高異型度であることが多いのですが、リンパ球浸潤が高度で多く、比較的予後が良好であることが示されています。これに対してCN-H型は予後不良であり、MSI型、CN-L型の予後はPOLE型とCN-H型の中間に位置付づけられます。形態学的にはPOLE型とMSI型は類内膜癌に相当し、CN-L、CN-Hは類内膜癌に加えて漿液性癌を含みます。これを組織型からみた場合、興味深いことに漿液性癌の90%以上はCIN-Hで、分子遺伝学的に比較的単一な腫瘍であるのに対して、類内膜癌はいずれのサブタイプも含んでおり、遺伝子発現パターンの観点から多彩な腫瘍を内包していることがわかりました。 このような分子遺伝学的分類は組織亜型との相関が検証されている他、将来的には分子標的治療に応用されていく可能性があり、今後これらの分子遺伝学的亜型分類を行うための代替マーカーが模索されていることになるかもしれません。
1. Cancer Genome Atlas Research N, et al: Integrated genomic characterization of endometrial carcinoma. Nature. 2013; 497: 67-73.
2. Bakhsh S, et al: Histopathological features of endometrial carcinomas associated with POLE mutations: implications for decisions about adjuvant therapy. Histopathology. 2015.